Nueva norma elimina la barrera para ingresar al tratamiento de las personas que viven con el VIH y se adecua a las recomendaciones de la Organización Mundial de la Salud, pero entrará en vigencia en seis meses.
Escribe: Marlon Castillo Castro / Conexión Vida
Lima, Perú.- Las personas que viven con el VIH, podrán tener acceso inmediato al programa de tratamiento antirretroviral (TARV), según lo dispone la Resolución Ministerial 215-2018 publicada hoy en el diario oficial El Peruano, que aprueba la “Norma Técnica de Salud de Atención Integral del Adulto con Infección por el Virus de la Inmunodeficiencia Humana (VIH)”.
Dolutegravir y Maraviroc, son los medicamentos antirretrovirales que se suman a los productos farmacéuticos que serán parte del tratamiento para el VIH en el Perú
De esta manera, toda persona con diagnóstico de infección por VIH será evaluada por el médico para el inicio del TARV en un lapso no mayor a una semana, independientemente del estadio clínico y/o su recuento de linfocitos T CD4 (nivel de defensas) y carga viral (Conteo de número de virus por milímetro cúbico en la sangre). Es decir, que ya no deberá esperar a tener un sistema de defensas debilitado para ingresar al tratamiento médico, según las recomendaciones dadas por la Organización Mundial de la Salud (OMS) en el año 2015, en el que se adecuaron las guías de tratamiento para evitar mayores complicaciones a la salud de las personas que viven con el VIH.
Además, las personas diagnosticadas con el VIH deberán pasar por pruebas de laboratorio y exámenes como: Hemograma, glucosa, creatinina sérica, úrea, descarte de tuberculosis, infecciones de transmisión sexual, hepatitis, CD4 y Carga Viral, entre otras.

Un equipo multidisciplinario, que incluye la entrevista de enfermería, evaluación psicológica, el informe social u otras evaluaciones que se requieran, podrán completarse durante los días posteriores al inicio de tratamiento.
Seis meses para su aplicación
Sin embargo, la implementación de la nueva Norma Técnica del TARV se realizará en forma progresiva, en los ciento ochenta días (6 meses) posteriores a su publicación y teniendo en consideración los recursos y capacidades del sistema de salud en sus diferentes niveles (nacional, regional y local).
Puede leer: OMS recomienda inicio temprano para tratamiento del VIH
Se establece también que toda persona que vive con el VIH, deberá ser incluido al Seguro Integral de Salud – SIS, siempre quo no ser beneficiario de otras Instituciones Administradoras de Fondos de Aseguramiento en Salud (IAFAS), como EsSalud, Sanidad de Fuerzas Armadas, Policía Nacional y otras; cumpliendo con los requisitos correspondientes, aunque en este punto, existe un entrampamiento de carácter jurídico para asegurar este derecho a la afiliación gratuita al SIS.
Ingreso de nuevos medicamentos y terapias
 Dolutegravir y Maraviroc, son los medicamentos antirretrovirales que se suman a los productos farmacéuticos que serán parte del tratamiento para el VIH en el Perú, para la segunda línea de tratamiento, es decir cuando la persona que vive con el VIH hubiera desarrollado resistencia al esquema inicial de medicación.
Dolutegravir y Maraviroc, son los medicamentos antirretrovirales que se suman a los productos farmacéuticos que serán parte del tratamiento para el VIH en el Perú, para la segunda línea de tratamiento, es decir cuando la persona que vive con el VIH hubiera desarrollado resistencia al esquema inicial de medicación.
El dolutegravir pertenece a una clase (un grupo) de medicamentos contra el VIH llamados inhibidores de la integrasa. Los inhibidores de la integrasa bloquean una enzima del VIH llamada integrasa. (Una enzima es una proteína que desencadena o acelera una reacción química.) Al bloquear la integrasa, esos inhibidores evitan la multiplicación del VIH y pueden reducir su concentración en el cuerpo. En tanto el Maraviroc forma parte del grupo de medicamentos contra el VIH llamados antagonistas de CCR5. Estos productos impiden que el VIH entre en ciertas células del sistema inmunitario y las infecte. Esto evita la multiplicación del virus y puede reducir su concentración en el cuerpo.
Ambos medicamentos se comercializan hace más de dos años en los Estados Unidos y están aprobados por la la Administración de Alimentos y Medicamentos de los Estados Unidos (U.S. Food and Drug Administration, FDA).
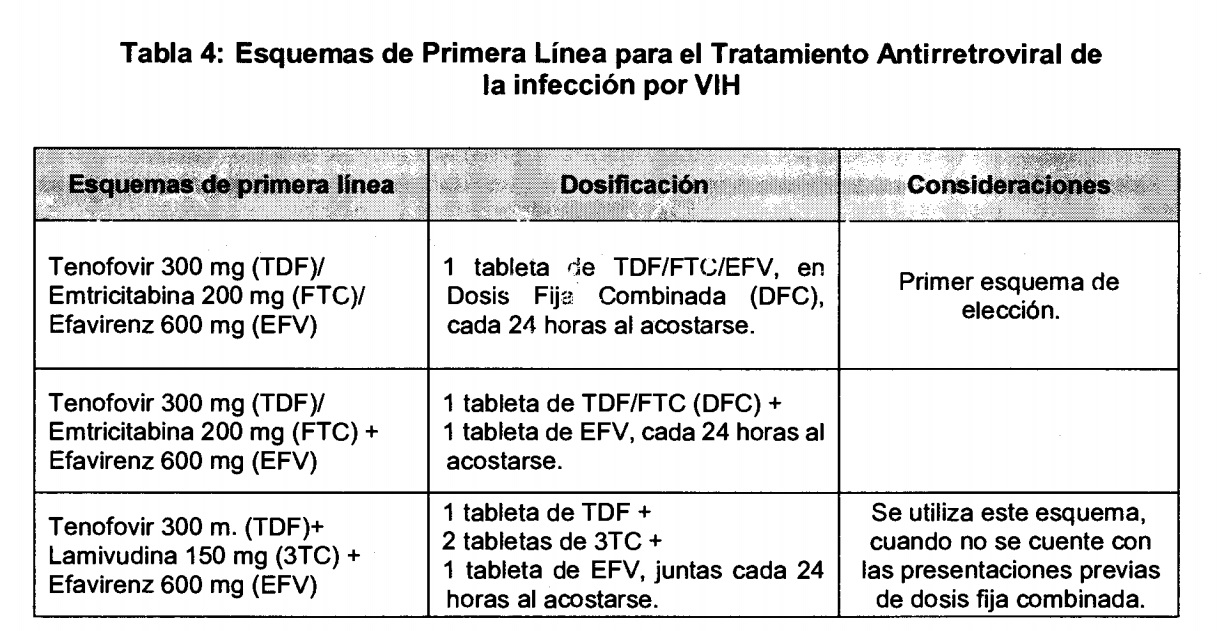
Ver cuadro del primer esquema de tratamiento para el VIH.
El documento normativo, establece que no se puede usar dolutegravir en mujeres gestantes, que estén dando de lactar o personas con co-infección TB-VIH.
Descarga la Norma Técnica aprobada ➡
Agrega que los medicamentos requeridos para esquemas de primera línea o segunda línea de personas con VIH que han hecho resistencia a los medicamentos, deben ser evaluados y autorizados por el Comité de Expertos en Atención Integral del Adulto con VIH.
Queda analizar a profundidad esta nueva norma técnica y establecer el financiamiento adecuado para asegurar la entrega oportuna de los medicamentos, ahora que ingresará un mayor número de personas al TARV y se deberá adquirir productos de alto costo como el dolutegravir, maraviroc, atazanavir y raltegravir.




Hola buenas tardes como se puede hacer para que un familiar entre en este programa, a el le detectaron vih
Porsupuesto, cualquier persona puede ingresar al programa.
Cualquier duda llame al 4810392
Buenas noches quisiera saber si este programa sigue o ya fue cancelado
El programa no fue cancelado, pero por ahora se encuentra suspendido por la emergencia sanitaria. Esperamos que en las próximas semanas se estabilice.
Gracias por seguirnos.
Buenas noches!
Cómo podrían hacer las personas que han tenido relaciones sexuales y se ha roto el condon, pero aún no han pasado las 72 horas después de la exposición? Podría encontrar tratamiento del programa aún estando en la selva central?